Articles
- Page Path
- HOME > Korean J Community Nutr > Volume 27(3); 2022 > Article
- Research Article [재출판] 위암 수술 후 외래환자의 영양상태 평가: 5가지 영양검색도구의 비교연구
-
조재원
 , 윤지영
, 윤지영 , 최민규
, 최민규 , 라미용
, 라미용 , 이정은
, 이정은
- [Republished study] Assessing Nutritional Status in Outpatients after Gastric Cancer Surgery: A Comparative Study of Five Nutritional Screening Tools
-
Jae Won Cho
 , Jiyoung Youn
, Jiyoung Youn , Min-Gew Choi
, Min-Gew Choi , Mi Young Rha
, Mi Young Rha , Jung Eun Lee
, Jung Eun Lee
-
Korean Journal of Community Nutrition 2022;27(3):205-222.
DOI: https://doi.org/10.5720/kjcn.2022.27.3.205
Published online: June 30, 2022
2서울대학교 생활과학대학 식품영양학과, 학생
3삼성서울병원 외과, 성균관대학교 의과대학, 교수
4삼성서울병원 영양팀, 영양사
5서울대학교 생활과학대학 식품영양학과, 교수
6서울대학교 생활과학연구소, 교수
1Unit manager, Department of Dietetic, Samsung Medical Center, Seoul, Korea

2Student, Department of Food and Nutrition, College of Human Ecology, Seoul National University, Seoul, Korea

3Professor, Department of Surgery, Samsung Medical Center, Sungkyunkwan University School of Medicine, Seoul, Korea

4Dietitian, Department of Dietetic, Samsung Medical Center Seoul, Korea

5Professor, Department of Food and Nutrition, Seoul National University, Seoul, Korea

6Professor, Research Institute of Human Ecology, Seoul National University, Seoul, Korea

-
Corresponding author:
Jung Eun Lee, Tel: +82-880-6834, Fax: +82-884-0305,
Email: jungelee@snu.ac.kr
- 377 Views
- 12 Download
- 1 Crossref
- 0 Scopus
Abstract
Objectives
This study examined the characteristics of patients according to nutritional status assessed by five nutritional screening tools: Patient-Generated Subjective Global Assessment (PG-SGA), NUTRISCORE, Nutritional Risk Index (NRI), Prognostic Nutritional Index (PNI), and Controlling Nutritional Status (CONUT) and to compare the agreement, sensitivity, and specificity of these tools.
Methods
A total of 952 gastric cancer patients who underwent gastrectomy and chemotherapy from January 2009 to December 2012 were included. The patients were categorized into malnutrition and normal status according to five nutritional screening tools one month after surgery. The Spearman partial correlation, Cohen’s Kappa coefficient, the area under the curve (AUC), sensitivity, and specificity of each two screening tools were calculated.
Results
Malnutrition was observed in 86.24% of patients based on the PG-SGA and 85.82% based on the NUTRISCORE. When NRI or CONUT were applied, the proportions of malnutrition were < 30%. Patients with malnutrition had lower intakes of energy and protein than normal patients when assessed using the PG-SGA, NUTRISCORE, or NRI. Lower levels of albumin, hemoglobin, total lymphocyte count, and total cholesterol and longer postoperative hospital stays were observed among patients with malnutrition compared to normal patients when NRI, PNI, or CONUT were applied. Relatively high agreement for NUTRISCORE relative to PG-SGA was found; the sensitivity was 90.86%, and the AUC was 0.78. When NRI, PNI, and CONUT were compared, the sensitivities were 23.72% for PNI relative to NRI, 44.53% for CONUT relative to NRI, and 90.91% for CONUT relative to PNI. The AUCs were 0.95 for NRI relative to PNI and 0.91 for CONUT relative to PNI.
Conclusions
NUTRISCORE had a high sensitivity compared to PG-SGA, and CONUT had a high sensitivity compared to PNI. NRI had a high specificity compared to PNI. This relatively high sensitivity and specificity resulted in 77.00% agreement between PNI and CONUT and 77.94% agreement between NRI and PNI. Further cohort studies will be needed to determine if the nutritional status assessed by PG-SGA, NUTRISCORE, NRI, PNI, and CONUT predicts the gastric cancer prognosis.
Published online Jun 30, 2022.
https://doi.org/10.5720/kjcn.2022.27.3.205
Abstract
Objectives
This study examined the characteristics of patients according to nutritional status assessed by five nutritional screening tools: Patient-Generated Subjective Global Assessment (PG-SGA), NUTRISCORE, Nutritional Risk Index (NRI), Prognostic Nutritional Index (PNI), and Controlling Nutritional Status (CONUT) and to compare the agreement, sensitivity, and specificity of these tools.
Methods
A total of 952 gastric cancer patients who underwent gastrectomy and chemotherapy from January 2009 to December 2012 were included. The patients were categorized into malnutrition and normal status according to five nutritional screening tools one month after surgery. The Spearman partial correlation, Cohen’s Kappa coefficient, the area under the curve (AUC), sensitivity, and specificity of each two screening tools were calculated.
Results
Malnutrition was observed in 86.24% of patients based on the PG-SGA and 85.82% based on the NUTRISCORE. When NRI or CONUT were applied, the proportions of malnutrition were < 30%. Patients with malnutrition had lower intakes of energy and protein than normal patients when assessed using the PG-SGA, NUTRISCORE, or NRI. Lower levels of albumin, hemoglobin, total lymphocyte count, and total cholesterol and longer postoperative hospital stays were observed among patients with malnutrition compared to normal patients when NRI, PNI, or CONUT were applied. Relatively high agreement for NUTRISCORE relative to PG-SGA was found; the sensitivity was 90.86%, and the AUC was 0.78. When NRI, PNI, and CONUT were compared, the sensitivities were 23.72% for PNI relative to NRI, 44.53% for CONUT relative to NRI, and 90.91% for CONUT relative to PNI. The AUCs were 0.95 for NRI relative to PNI and 0.91 for CONUT relative to PNI.
Conclusions
NUTRISCORE had a high sensitivity compared to PG-SGA, and CONUT had a high sensitivity compared to PNI. NRI had a high specificity compared to PNI. This relatively high sensitivity and specificity resulted in 77.00% agreement between PNI and CONUT and 77.94% agreement between NRI and PNI. Further cohort studies will be needed to determine if the nutritional status assessed by PG-SGA, NUTRISCORE, NRI, PNI, and CONUT predicts the gastric cancer prognosis.
서론
위암은 세계적으로 암의 주요 사망원인 중 다섯 번째에 해당하며[1], 아시아 지역에서 절반 이상의 환자들이 발생된다[2]. 국내에서 위암 발생률은 2019년 10만명당 57.4로 3순위이며[3], 사망률은 2020년 전체 암 사망자의 9.1%로 4순위에 해당되어 발생률과 사망률이 다른 암에 비해 높은 수준이다[4].
위암 완치를 위한 주된 치료는 수술이며, 화학요법 또는 방사선요법과 병행되기도 한다[5, 6]. 위 절제술 후 임상 결과는 수술 후 합병증의 발생과 중증도 및 영양상태에 크게 영향을 받는데, 이러한 요인들로 치료의 내약성과 암 진행을 예측할 수 있기 때문이다[7, 8]. 위암으로 수술을 받는 환자들은 경구 섭취의 감소와 영양흡수장애 등의 문제점으로 체중이 감소하고 영양불량 상태가 더 악화될 수 있으며, 이러한 영양불량상태는 종양 침윤, 암으로 인한 대사 변화[9], 면역저하 상태[7], 항암 치료에 대한 불응성[10], 낮은 생존율[11]과 밀접한 관련성이 있다. 따라서 임상영양사는 환자의 영양상태를 정확히 판정하여 영양 불량의 위험이 있는 환자들을 선별하고 적절한 영양 중재를 시행하여 영양상태를 개선시키는 것이 중요하다.
암환자의 영양상태를 판정하기 위해 다양한 영양검색도구(nutritional screening tool) 들이 사용되고 있다. 가장 많이 활용되고 있는 Patient-Generated Subjective Global Assessment (PG-SGA)는 체중의 변화, 식이 섭취 변화, 2주 이상 지속된 식품 섭취에 부정적 영향을 미치는 증상, 신체활동 변화 및 신체검사를 반영하는 주관적인 영양평가이다[12]. PG-SGA는 진행성 암환자의 예후 측면을 평가할 수 있을 뿐만 아니라 영양 관리의 효과를 모니터링 하는데 사용할 수 있다[13, 14]. 최근 스페인 연구진에 의해 개발된 NUTRISCORE는 체중 감소, 음식 섭취 감소뿐 아니라 암과 항암치료의 유형에 따라 점수화하여 종양 외래 환자의 영양불량 위험을 평가하는 영양검색도구이다[15]. 수술한 환자의 영양 상태를 판정하는 지표로 많이 사용되는 Nutritional Risk Index (NRI)는 혈청 알부민과 체중 상태를 결합하는 공식에 의해 산출되며, 장기간의 영양 불량 상태를 반영한다[16]. Prognostic Nutritional Index (PNI)는 혈청 알부민과 말초 혈액의 총 림프구 수(peripheral blood total lymphocyte count, TLC)를 포함한 공식으로 점수를 산출한다[17]. Controlling Nutritional Status (CONUT)는 혈청 알부민, 총 콜레스테롤, TLC 수치에 따라 점수화하여 계산하는 영양검색도구로, 단백질 대사, 면역 능력 및 지질 대사를 종합적으로 평가하며 영양 중재가 필요한 환자를 선별하고 환자의 반응을 예측하는 데 사용된다[18].
일부 선행 연구들에서 암 환자의 영양상태에 따른 중재와 치료의 영향을 예측하기 위해 영양검색도구들 간의 특성 및 관계에 대해 제시하고 있다. 스위스에서 200명 환자의 위장관 수술 후 합병증[19]이나, 중국에서 1,395명 구강암 환자를 대상으로 하여 생존율[20]을 예측하는데 NRI와 다른 영양검색도구들을 비교 평가하였다. 또한 PG-SGA를 기준으로 하여 암 외래환자의 영양불량 선별에 대한 민감도를 비교 평가하는 연구들도 있다[15, 21]. 그러나 영양검색도구들 간의 상관관계나 영양불량 선별력에 대해 일치되지 않고 있는 실정이며, 위 절제술을 시행한 위암환자만을 대상으로 한 연구는 미비한 실정이다.
따라서 본 연구에서는 위 절제술 후 1개월 경과 시점에 항암치료를 받는 위암 환자들을 대상으로 5가지 영양검색도구인 PG-SGA, NUTRISCORE, NRI, PNI, CONUT으로 평가된 영양 상태를 서로 비교하고 분석하였다. 이러한 영양검색도구들 간의 상관관계 및 영양불량 선별력 비교 분석을 통해 암환자 영양불량 진단 도구 사용에 대한 기초자료를 제공하고자 한다.
연구대상 및 방법
1. 연구 대상자 및 조사기간
본 연구는 2009년 1월부터 2012년 12월까지 삼성서울병원 위암센터에서 위 절제술을 시행하고 최소 1회 이상 항암치료를 시행한 위암 환자 1,940명을 대상으로 하였다. 제외 기준은 (1) 수술 전 International classification of Disease (ICD)-9에 의해 분류된 마라스무스 영양불량환자(n = 2), (2) 수술 후 누출과 같은 합병증으로 인해 정맥 영양 공급을 받으며 한달 이상 입원한 환자(n = 7), (3) 수술 전 항암화학요법을 받는 환자(n = 69), (4) 완화적 수술 환자(n = 164), (5) 장관기질종양(gastrointestinal stromal tumor, GIST) 수술 또는 다른 암으로 인한 항암치료를 받은 환자(n = 48), (6) 의무기록에서 영양검색도구의 영양평가에 필요한 자료들이 누락된 환자(n = 698)이다. 이러한 기준에 따라 1,940명 중 988명의 환자를 연구에서 순차적으로 제외하였으며, 최종적으로 총 952명 환자(남자 622명, 여자 330명)를 포함하였다(Fig. 1). 이 연구는 삼성서울병원 임상시험심사위원회(IRB)에 의해 승인(IRB No. 2017-11-025) 되었다.
Fig. 1
Flow diagram of study population inclusion
2. 연구 내용 및 방법
1) 임상 정보 및 생화학적 검사
연구대상자의 일반 사항에 해당하는 성별, 수술 시 연령, 암 단계별 병기, 수술방법, 동반질환, 항암치료방법, 재원 일수는 의무기록을 통해 후향적으로 조사하였다. 위암의 병기 단계는 American Joint Committee on Cancer 8th 개정판 Tumor-Node-Metastasis (TNM) 체계에 따라 결정하였다[22].
수술 후 1개월 경과 시점의 혈청 알부민, 헤모글로빈, TLC, 총 콜레스테롤 검사결과를 조사하였다. 알부민은 Brom Cresol Green (BCG)에 의한 비색법으로 측정하였으며, 헤모글로빈과 림프구는 Sysmex XN-9000 (Sysmex, Japan) 분석기를 사용하여 측정하였고, 총 콜레스테롤은 효소 비색법으로 측정하였다. 정상 범위의 기준은 혈청 알부민의 경우 ≥ 3.5 g/dL, 헤모글로빈은 빈혈로 정의하는 세계보건기구의 역치를 사용하였다(여성 ≥ 12 g/dL, 남성 ≥ 13 g/dL)[23]. TLC 수준은 mm3 당 1,000 이상으로 정의하였으며[24], 총 콜레스테롤 수치는 130 mg/dL 이상을 정상 범위로 하였다[25].
2) 신체계측
수술 후 1개월 경과 시점에 항암치료 받기 전 영양 상담을 시행하면서 환자의 키와 몸무게는 디지털 신장·체중계를 사용하여 측정한 후 BMI를 계산하였다. 저체중은 세계 보건기구의 아시아인 기준치에 따라 18.5 kg/m2 미만으로 정의하였다[26].
3) 식습관 특성
수술 후 1개월 경과 시점에 항암치료가 결정되면 영양 상담을 시행하게 되는데 영양사가 환자와의 면담을 통해 식사와 간식 횟수, 식사 시 소요시간, 소화기증상의 유무를 파악하였으며, 1회 24시간 식사 기록을 통해 에너지와 단백질 섭취량을 조사하고 에너지와 단백질의 요구량(30 ~ 35 kcal/kg/day, 1.0 ~ 1.5 g/kg/day)[27] 대비 섭취 비율을 분석하였다.
4) 영양 평가 방법
영양 상담 대상 환자들의 영양판정에는 PG-SGA, NUTRISCORE, NRI, PNI, CONUT를 사용하였다. 환자들의 영양상태는 각 영양검색도구들의 기준에 따라 영양상태 정상군과 영양불량군으로 분류하였다.
PG-SGA는 Ottery에 의해 개발되었으며 환자가 작성하는 범주(체중 감소, 음식 섭취, 임상 증상, 활동 및 기능)과 임상전문가가 작성하는 범주(질병, 대사 요구 및 신체 검사)를 포함한다. 영양사가 PG-SGA의 각 범주에 작성된 내용을 확인하여 환자의 영양 상태를 정상인지(stage A) 영양불량(stage B와 stage C)인지를 분류 평가하고 각 범주의 점수를 합산하여 총 점수를 계산하였다. 계산한 점수가 높을수록 영양불량상태가 더 심하고 영양 중재가 필요하다는 것을 나타낸다[12, 28].
NUTRISCORE는 영양사가 환자의 체중감소, 식욕 저하로 인한 섭취량 감소, 종양 위치와 항암 치료의 종류를 조사한 후 각 항목의 점수를 반영하는 시스템을 이용하여 영양 불량 위험을 결정하였다. NUTRISCORE의 점수가 5점 이상일 경우 영양불량 위험이 있는 것으로 간주된다[15].
NRI는 (1.519 × serum albumin (g/L)) + (41.7 × current weight/usual weight (kg))의 공식을 사용하였으며, 평소 체중은 수술 전 6개월 이상 안정된 체중이나 입원 시 측정한 체중으로, 현재 체중은 상담 시점에 측정된 체중을 적용하였다. NRI의 영양상태 기준은 선행된 연구들에 의하여 점수가 100 초과인 환자는 영양상태 정상군으로, 100 이하는 영양불량군으로 분류하였다[16, 29].
PNI는 (10 × serum albumin (g/dL)) + (0.005 × total lymphocyte count (per mm3))의 공식을 이용하여 계산하였으며, PNI에 대한 이전 연구에서는 점수가 45 이상일 때 위장관 수술을 안전하게 수행 할 수 있다고 제시하고 있어[7, 30] 그 기준에 따라 45 이상을 정상군, 45 미만을 영양불량군으로 구분하였다.
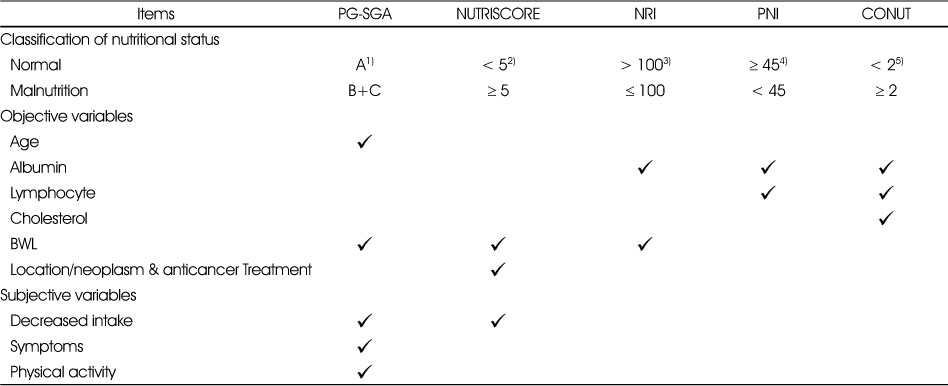
CONUT은 혈청 알부민 농도, 총 콜레스테롤 수치, 말초 혈액의 총 림프구 수를 각 기준에 의해 점수를 부여하여, 네 가지 범주(정상 0 ~ 1점, 경증 2 ~ 4점, 중등도 5 ~ 8점, 중증 영양 불량 위험 9 ~ 12점)로 분류하였다[31]. 본 연구에서는 환자를 CONUT 점수가 0 ~ 1점은 정상군, 2점 이상은 영양불량군으로 구분하였다[18]. 각 영양검색도구들의 판정에 포함되는 항목에 대해 Table 1에 정리하였다. 5가지 영양검색도구들 중 NRI, PNI 및 CONUT는 혈액검사 정보를 필요로 하는 반면, PG-SGA와 NUTRISCORE는 환자의 섭취량과 영양 관련 증상 등의 주관적 정보를 포함한다.
Table 1
Malnutrition criteria and items included in five nutritional screening tools
3. 자료 분석 방법
영양검색도구들의 영양관련인자 항목들에 대한 평균과 표준편차, 빈도와 백분율을 계산하였으며, 정상군과 영양불량군 특징 간의 유의미한 차이를 검증하기 위해 범주형 변수에서는 카이제곱 검정을, 연속 변수는 정규분포여부에 따라 맨-휘트니 검정 또는 t-검정을 사용하였다. 영양검색도구 간의 상관관계 분석을 위해 수술 당시의 연령과 성별을 보정하여 스피어만 편상관분석을 시행하였으며, 추가로 수술 형태와 위암 병기를 보정한 상관관계를 제시하였다. 그리고 PG-SGA, NUTRISCORE, CONUT은 점수가 높을수록 영양 불량하고, NRI와 PNI는 점수가 낮을수록 영양 불량하여 NRI와 PNI를 역수로 변환하여 상관관계를 분석하였다. 또한 영양검색도구들의 정상군과 영양불량군의 일치율은 일치도 백분율과 카파 상관계수(Cohen’s Kappa Coefficient, K)를 구하여 비교하였다. 카파 상관계수는 K < 0.0 유사성 거의 없음(poor), 0.0 ≤ K ≤ 0.2는 유사성 낮음(slight), 0.2 < K ≤ 0.4 타당함(fair), 0.4 < K ≤ 0.6 유사성 중등(moderate), 0.6 < K ≤ 0.8 유사성 높음(substantial), 0.8 < K 거의 일치함(almost perfect)으로 분류하였다[32]. 또한 Receiver Operating Characteristic (ROC) curves를 그려 Area Under the Curve (AUC)와 민감도 및 특이도를 비교 분석하였다. AUC는 ≥ 0.9 매우 높음(excellent), 0.8 ≤ AUC < 0.9 높음(good), 0.7 ≤ AUC < 0.8 타당(fair), AUC < 0.7 낮음(poor)으로 분류하였다[33]. 모든 통계 분석은 SAS 9.4 (SAS Institute, Cary, NC, USA) 소프트웨어를 이용하였으며, 모든 통계적 가설은 양측 검정, 유의수준 0.05를 기준으로 수행하였다.
결과
1. 대상자의 일반적 특성
연구대상자의 일반적 특성은 Table 2에 정리하였다. 전체 환자수는 952명이었으며, 연령은 평균 55.34세로 60세 이상은 전체의 37.71%이었다. 남자는 622명(65.34%), 여자는 330명(34.66%)이며, 수술 형태 중 위 부분절제술이 전체의 64.92%로 위 전절제술보다 더 많고, 위암 병기는 TMN 체계에 따라 분류하였을 때 3기가 44.54%이었다. 항암치료방법 중 항암화학 방사선치료(combined chemotherapy and radiation therapy, CCRTx)로 치료한 환자가 전체의 47.69%로 조사되었고 저알부민혈증의 환자는 전체의 2.94%이었다. 빈혈 환자는 전체의 56.72%이었고, 림프구감소증은 전체의 5.57%이었으며 저콜레스테롤혈증은 전체의 10.71%이었다. BMI의 평균은 21.78 kg/m2로 18.5 kg/m2 미만의 경우가 전체의 9.14%이었다. 전체 대상자의 수술 후 체중감소 평균은 5.24 kg으로 5 kg 이상 감소한 환자들은 전체의 51.47%에 해당되며 수술 후 1개월간 5% 이상 감소한 경우는 전체의 83.72%, 10% 이상의 체중 감소는 4.31%이었다. 에너지의 요구량 대비 섭취비율은 75% 미만인 경우가 전체의 56.72%였으며, 단백질의 요구량 대비 섭취비율은 75% 미만인 경우가 55.70%로 조사되었다.
Table 2
Characteristics of gastric cancer outpatients (n = 952)
2. 영양검색도구들로 분류한 영양상태에 따른 대상자의 특성 비교
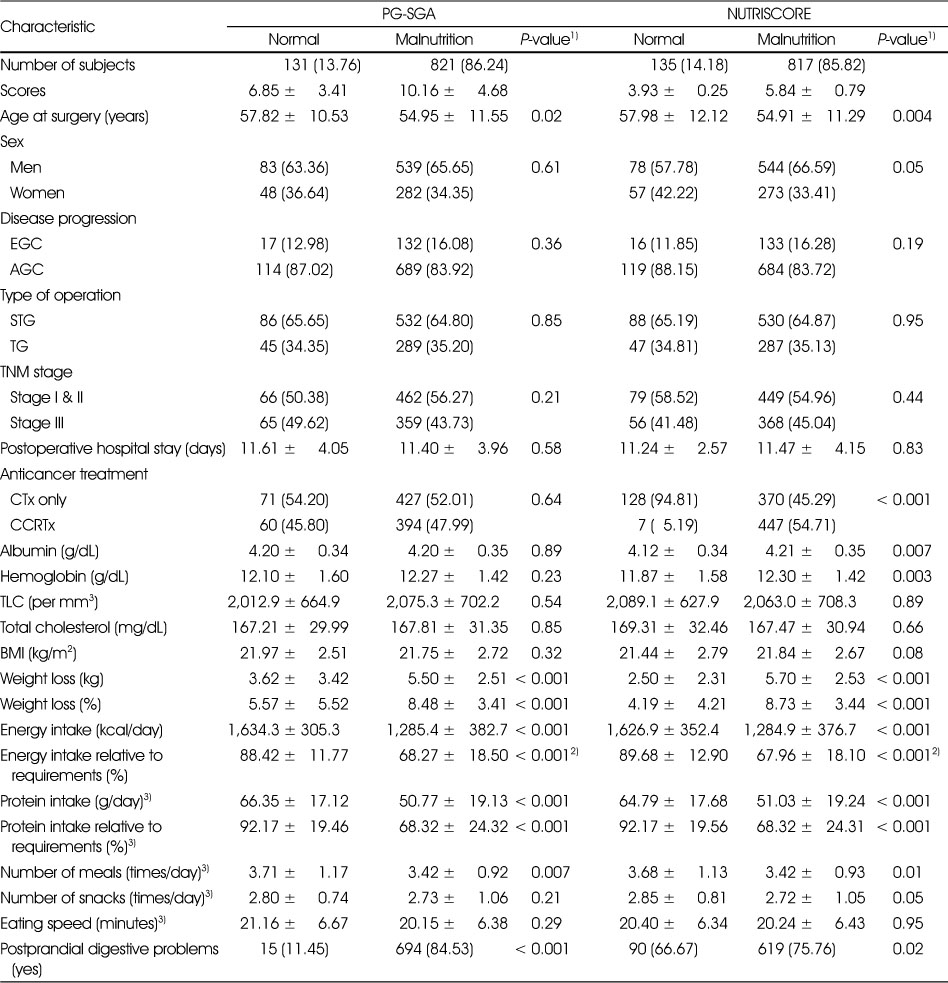
PG-SGA, NUTRISCORE, NRI, PNI, CONUT 각 영양검색도구의 기준에 따라 영양상태 정상군과 영양불량군으로 구분한 결과 및 그에 따른 특성을 Table 3과 Table 4에 제시하였다. 영양불량군은 PG-SGA의 기준에 따르면 전체의 86.24%, NUTRISCORE의 기준에 따르면 85.82%이었으며, PG-SGA와 NUTRISCORE의 기준에 따른 정상군에 비해 영양불량군의 평균 연령이 유의적으로 낮았다(Table 3). 생화학적 지표의 경우, PG-SGA에 따른 정상군과 영양불량군 사이의 유의적인 차이가 없는 반면, NUTRICORE에 따른 영양불량군에서 정상군보다 알부민과 헤모글로빈 수치가 유의적으로 높았다. PG-SGA와 NUTRISCORE에 따른 영양불량군은 정상군에 비해 수술 후 체중감소가 각각 5.50 kg (8.48%), 5.70 kg (8.73%)로 감소 정도가 더 컸다(P < 0.001). 또한 PG-SGA와 NUTRISCORE에 따른 영양불량군에서 에너지 섭취량은 약 1,285 kcal로 정상군의 약 1,600 kcal에 비해 유의적으로 낮았으며(P < 0.001), 요구량대비 에너지 섭취비율 역시 영양불량군에서는 정상군에 비해 70% 미만으로 낮았다(P < 0.001). PG-SGA와 NUTRISCORE에 따른 영양불량군에서 단백질 섭취량은 약 51 g, 요구량 대비 단백질 섭취비율은 약 68%로 정상군에 비해 유의적으로 낮았다(P < 0.001). PG-SGA와 NUTRISCORE에 따른 영양불량군의 평균 식사 횟수가 모두 3.42회로 각 정상군의 3.71회, 3.68회보다 유의적으로 낮았으며, 섭취에 영향을 주는 소화기 증상이 있는 환자의 비율은 영양불량군에서 각 84.53%, 75.76%로 정상군보다 유의적으로 더 높았다.
Table 3
Characteristics of patients according to PG-SGA and NUTRISCORE at 1 month after gastrectomy
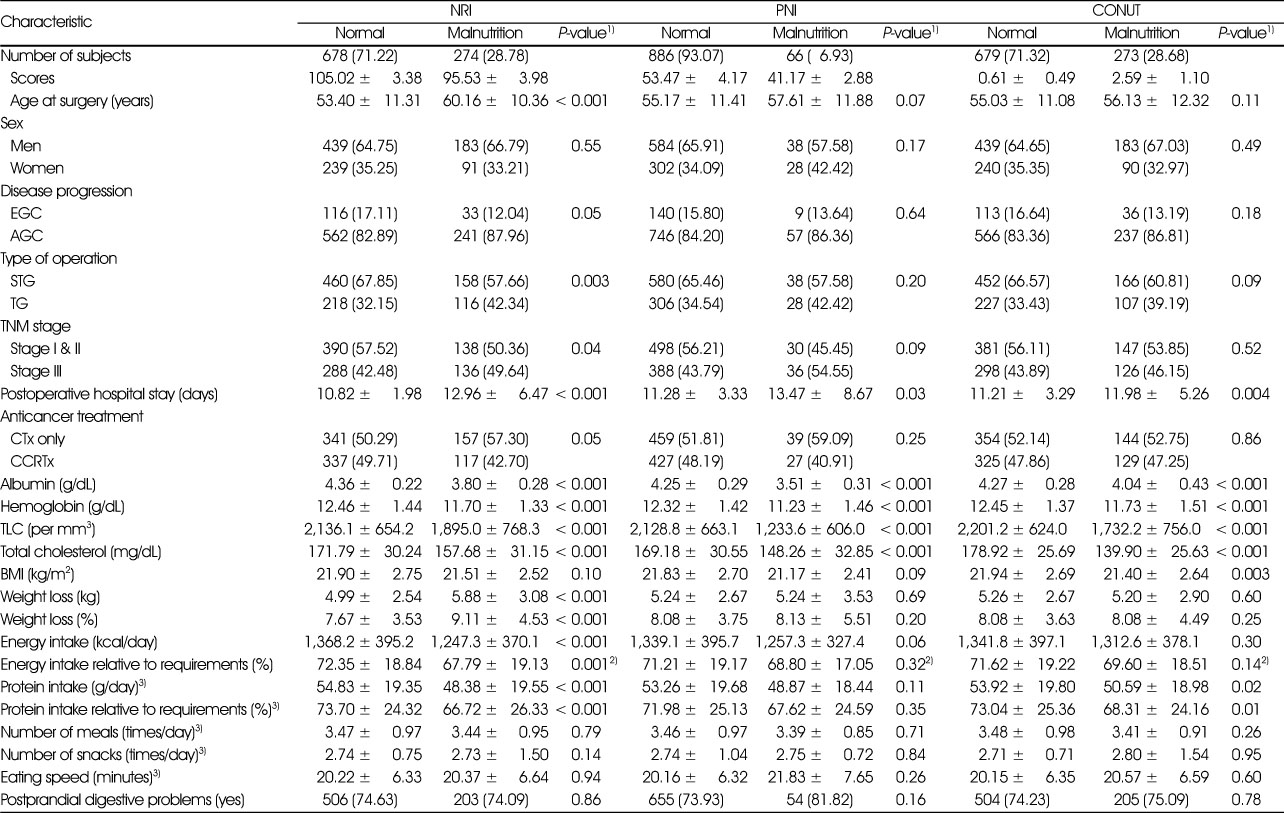
Table 4
Characteristics of patients according to NRI, PNI, and CONUT at 1 month after gastrectomy
NRI, PNI, CONUT에 따른 영양불량군은 각 전체의 28.78%, 6.93%, 28.68%로 관찰되었다(Table 4). NRI에 따른 영양불량군의 평균 연령은 정상군에 비해 유의적으로 높았으며, 위 전절제술 비율이 정상군에 비해 유의적으로 높았다. 또한 NRI에 따른 영양불량군에서 정상군에 비해 위암 병기가 3기인 비율이 유의적으로 높았다(P = 0.04). NRI, PNI, CONUT에 따른 영양불량군의 재원 일수 평균은 각 12.96일, 13.47일, 11.98일로, 정상군의 각 10.82일, 11.28일, 11.21일보다 유의적으로 높게 나타났다. 영양불량군의 평균 혈청 알부민 수치가 NRI에서는 3.80 g/dL, PNI에서는 3.51 g/dL, CONUT에서는 4.04 g/dL이며 NRI, PNI, CONUT 각각 정상군의 4.36 g/dL, 4.25 g/dL, 4.27 g/dL 수치보다 유의적으로 낮았다(P < 0.001). 헤모글로빈과 총 림프구 수, 콜레스테롤 평균 수치 역시 NRI, PNI, CONUT에서 영양불량군의 수치가 정상군의 수치보다 유의적으로 낮았다. CONUT에 따른 영양불량군에서 BMI가 정상군보다 유의적으로 낮았으며, NRI에서 영양불량군의 체중감소가 정상군보다 유의적으로 크게 나타났다. NRI에 따른 영양불량군에서 에너지 섭취량과 요구량 대비 에너지섭취비율이 각각 1,247.3 kcal, 67.79%로 정상군의 1,368.2 kcal, 72.35%에 비해 유의적으로 낮았다. NRI와 CONUT에 따른 영양불량군의 단백질 섭취량과 요구량 대비 단백질섭취비율은 정상군에 비해 유의적으로 낮았다.
3. 영양검색도구들 간의 상관관계
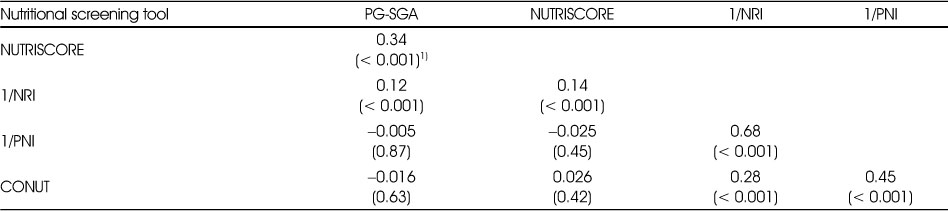
영양검색도구들의 점수에 따른 상관관계를 분석한 결과는 Table 5에 정리하였다. PG-SGA, NUTRISCORE, CONUT은 점수가 높을수록 영양불량상태가 심해지며, NRI와 PNI는 점수가 낮을수록 영양불량상태가 심해진다. NRI와 PNI를 역수로 변환하여 분석한 결과, PG-SGA와 NUTRISCORE의 상관계수는 0.34, PG-SGA와 1/NRI의 상관계수는 0.12이었다(P < 0.001). NUTRISCORE와 1/NRI의 상관계수는 0.14이며, 1/NRI와 1/PNI의 상관계수는 0.68이고, 1/NRI와 CONUT의 상관계수는 0.28, 1/PNI와 CONUT의 상관계수는 0.45이었다(P < 0.001). 1/NRI과 1/PNI가 가장 높은 상관관계를 보였으며, 1/PNI와 CONUT, PG-SGA와 NUTRISCORE, 1/NRI와 CONUT순으로 높게 나타났다. 또한 수술 시 연령과 성별 외에 수술 형태, 위암 병기를 추가 보정하여 분석한 결과에서도 1/NRI과 1/PNI의 상관계수는 0.68로 가장 높았으며, PG-SGA와 NUTRISCORE의 상관계수는 0.33이었고, 다른 도구들 간의 상관계수도 위의 결과와 유사하게 나타났다(자료제시하지 않음).
Table 5
Spearman partial correlation coefficients between two nutritional screening tools at 1 month after gastrectomy
4. 영양검색도구들 간의 일치도 평가
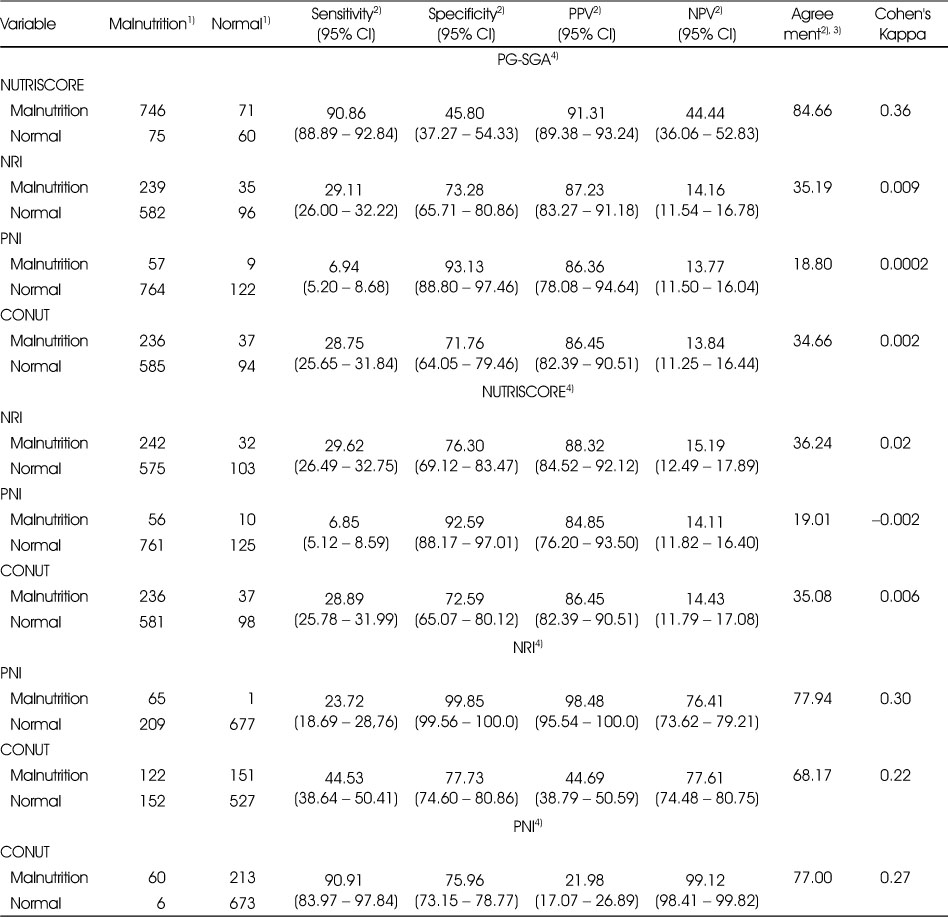
수술 후 1개월 경과 시점에 영양검색도구들에 따라 영양상태 정상군과 영양불량군 두 집단으로 구분하여 일치도를 나타낸 결과는 Table 6에 제시하였다. PG-SGA에서 영양불량군으로 분류된 대상자 821명 중 NUTRISCORE에서 746명이 영양불량군에 해당되어 민감도(sensitivity)가 90.86%이며, 정상군으로 분류된 대상자 131명 중 NUTRISCORE의 정상군은 60명으로 특이도(specificity)는 45.8%이고 양성예측치(positive predictive value, PPV)가 91.31%이었다. PG-SGA와 NUTRISCORE와의 일치도 백분율이 84.66%로 다른 영양검색도구들에 비해 가장 높았으며, 카파 상관계수는 0.36으로 타당한 수준이었다. PG-SGA와 NRI, PNI, CONUT 간의 일치도 백분율은 각각 35.19%, 18.80%, 34.66%이었으며, 카파 상관계수는 모두 0.05이하로 유사성이 낮은 수준이었다. NUTRISCORE를 기준치로 산출한 NRI, PNI, CONUT 간의 일치도 백분율은 각각 36.24%, 19.01%, 35.08%이었으며, 카파 상관계수는 0.1이하로 유사성이 낮은 수준이었다. NRI에서 영양불량군으로 분류된 대상자 274명 중 PNI에서 65명이 영양불량군에 해당되어 민감도가 23.72%인 반면, 정상군으로 분류된 대상자 678명 중 PNI의 정상군은 677명으로 특이도는 99.85%였다. NRI와 PNI, CONUT간의 일치도 백분율은 각각 77.94%, 68.17%이었으며, 카파 상관계수는 각각 0.30, 0.22로 타당한 수준이었다. PNI에서 영양불량군으로 분류된 대상자 66명 중 CONUT에서 60명이 영양불량군에 해당되어 민감도가 90.91%이며, 정상군으로 분류된 대상자 886명 중 CONUT의 정상군은 673명으로 특이도는 75.96%이었다. PNI와 CONUT에서는 일치도 백분율이 77%이었으며 카파 상관계수가 0.27로 타당한 수준이었다. NRI 점수에서 100이 아닌 97.5 기준[16]으로 정상군과 영양불량군을 구분하여 PNI와 비교하면 민감도가 34.94%, 특이도는 98.98%, 일치도 백분율은 87.82%으로 나타났으며, 연구 대상자에 따른 PNI 점수의 10번째 백분위수 46.6를 기준[34]으로 구분한 PNI와 CONUT를 비교하면 민감도가 83.51%, 특이도가 77.54%, 일치도 백분율은 78.15%이었다(자료제시하지 않음).
Table 6
Agreement of nutritional status between nutritional screening tools
5. 영양검색도구들 간의 ROC와 AUC 비교
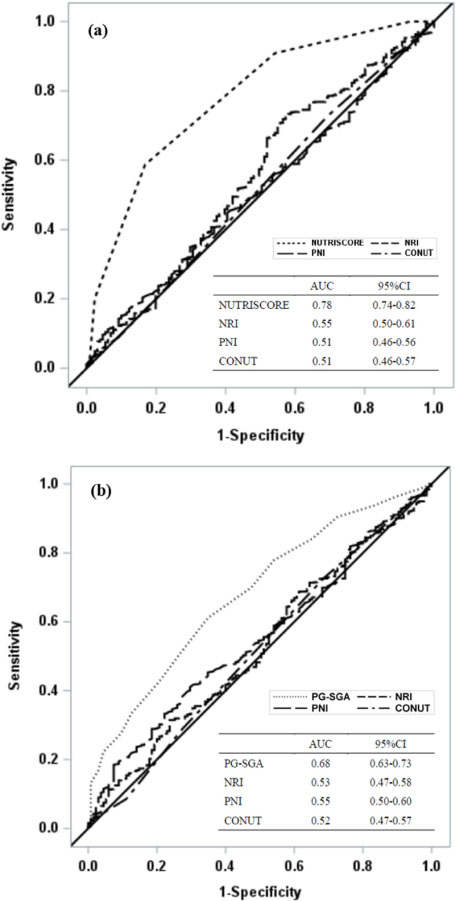
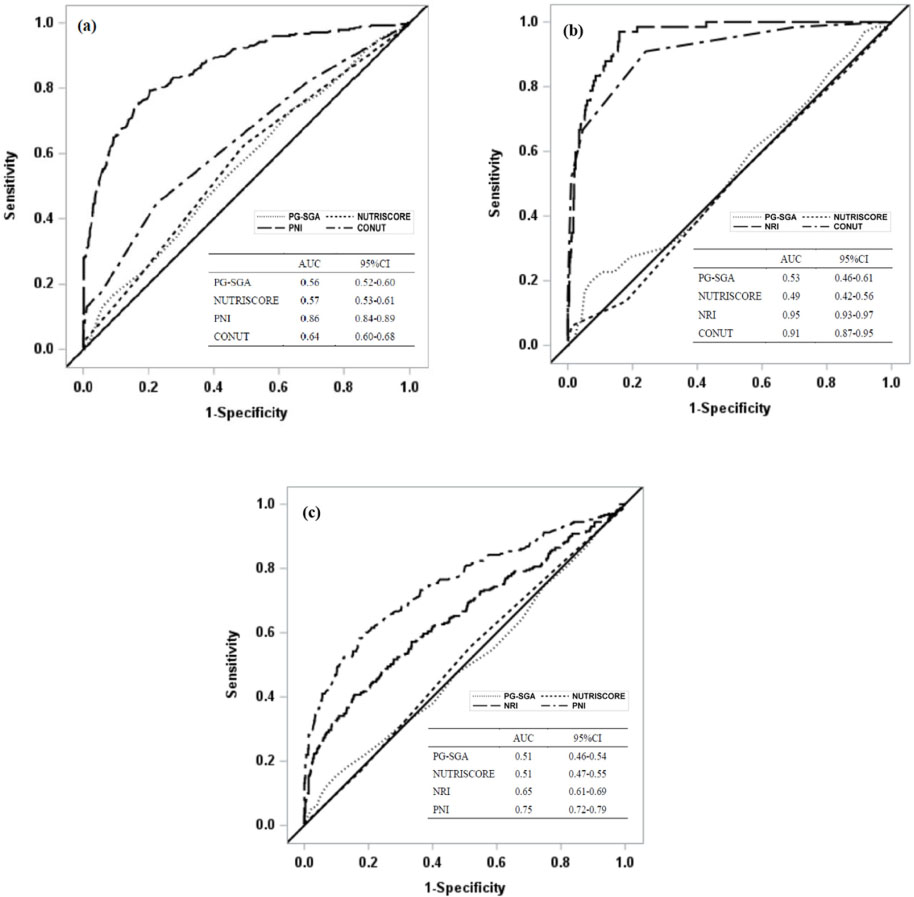
PG-SGA, NUTRISCORE, NRI, PNI, CONUT 점수에 따른 ROC 곡선을 그려서 Fig. 2와 Fig. 3에 제시하였으며, 각 영양검색도구들의 영양상태 선별에 대한 일치도를 AUC로 비교하였다. Fig. 2에서 PG-SGA에 대한 NUTRISCORE의 AUC는 0.78 (95% CI: 0.74-0.82)로 타당한 수준(fair)의 일치도를 나타냈으며, NUTRISCORE에 대한 PG-SGA의 AUC는 0.68 (95% CI: 0.63-0.73)이었다. 그 외의 도구를 쌍으로 비교한 결과에서 AUC는 0.51 ~ 0.55 정도로 일치도가 낮았다. Fig. 3에서 NRI에 대한 PNI의 AUC는 0.86 (95% CI: 0.84-0.89)이고, PNI에 대한 NRI의 AUC는 0.95 (95% CI: 0.93-0.97)이며 CONUT의 AUC는 0.91 (95% CI: 0.87-0.95)로 높은 수준의 일치도를 나타냈다. CONUT에 대한 PNI의 AUC는 0.75 (95% CI: 0.72-0.79)이었으며, 그 외 도구를 쌍으로 비교한 결과에서 AUC는 0.49 ~ 0.65 정도로 일치도가 낮았다.
Fig. 2
Receiver operating characteristic curves for comparisons among PG-SGA, NUTRISCORE, NRI, PNI, and CONUT (a) AUC-of-ROC curves of NUTRISCORE, NRI, PNI, and CONUT were compared with the AUC of PG-SGA. (b) AUC-of-ROC curves of PG-SGA, NRI, PNI, and CONUT were compared with the AUC of NUTRISCORE.
ROC, receiver operating characteristic; AUC, the area under the curve; PG-SGA, patient generated-subjective global assessment; NRI, nutritional risk index; PNI, prognostic nutritional index; and CONUT, controlling nutritional status
Fig. 3
Receiver operating characteristic curves for comparisons among PG-SGA, NUTRISCORE, NRI, PNI, and CONUT (a) AUC-of-ROC curves of PG-SGA, NUTRISCORE, PNI, and CONUT were compared with the AUC of NRI. (b) AUC-of-ROC curves of PG-SGA, NUTRISCORE, NRI, and CONUT were compared with the AUC of PNI. (c) AUC-of-ROC curves of PG-SGA, NUTRISCORE, NRI, and PNI were compared with the AUC of CONUT.
ROC, receiver operating characteristic; AUC, the area under the curve; PG-SGA, patient generated-subjective global assessment; NRI, nutritional risk index; PNI, prognostic nutritional index; and CONUT, controlling nutritional status
고찰
본 연구는 수술 후 1개월 경과 시점에 항암치료를 받는 위암 환자들을 대상으로 5가지 영양검색도구들을 활용하여 영양상태를 정상군과 영양불량군으로 구분하고 그에 따른 특성을 비교 및 분석해 보았으며, 영양검색도구들 간의 상관관계와 영양불량의 선별력 차이를 파악하였다. PG-SGA, NRI, PNI, CONUT 등의 영양검색도구들을 활용하여 위암 환자의 수술 전 영양상태를 평가하고 합병증이나 생존율과의 연관성에 대해 제시한 선행연구들은 있으나[34, 35, 36], 수술 후 영양상태에 대한 연구는 많지 않다. 스페인에서 항암치료를 시작하는 외래 암환자를 대상으로 영양불량상태를 조기 선별하고 중재하는데 NUTRISCORE을 활용하여 진행한 연구들은 있으나[37, 38], 위암 환자만을 대상으로 한 연구는 거의 없다. 또한 수술 후 1개월 경과 시점에 항암화학요법 치료를 받는 위암 환자들을 대상으로 다양한 영양검색도구들을 사용하여 영양불량상태를 선별하고 비교하거나 영양검색도구들 간의 상관관계를 살펴본 연구 또한 미비하므로 본 연구를 시행하게 되었다.
분석해 본 결과, 5가지 영양검색도구들 중 PG-SGA와 NUTRISCORE 간에는 뚜렷한 양의 상관관계(r = 0.34)가 있었으며, 카파 상관계수가 0.36으로 타당한 수준이고, 다른 영양검색도구들에 비해 가장 높은 일치도 백분율(84.66%)을 나타냈다. PG-SGA 기준으로 산출한 NUTRISCORE의 특이도는 45.80%로 낮으나 민감도와 양성예측치가 각각 90.86%, 91.31%로 높았으며, 이러한 높은 일치도는 높은 민감도에 기인한 것으로 보인다. PG-SGA에 대한 NUTRISCORE의 AUC는 0.78로 타당한(fair) 수준의 일치를 나타냈다.
외래 암환자 394명을 대상으로 한 Arribas 등의 연구[15]에서는 PG-SGA와 NUTRISCORE의 카파 상관계수가 0.88이었으며, PG-SGA에 대한 NUTRISCORE의 민감도와 특이도, 양성예측치가 각각 97.3%, 95.9%, 84.8%로 모두 높았고, AUC가 0.95로 높게 나타났다. Arribas 등의 연구에서는 15종 이상의 다양한 암환자가 포함되었으며, 위암을 포함한 상부 소화기 암환자는 전체의 10% 미만에 해당되었다. 본 연구와 같이 수술한 위암 환자만을 대상으로 하여 PG-SGA와 NUTRISCORE를 분석한 연구는 없으나, PG-SGA를 기준으로 다른 영양검색도구들을 비교한 연구들이 있다. 위암으로 위절제술을 시행한 입원환자 174명를 대상으로 한 국내연구에서는 서울대학교병원 영양검색도구(SNUH-NSI), Nutrition Risk Screening-2002 (NRS-2002)를 이용하여 영양불량상태를 평가하고 PG-SGA에 따른 영양평가결과와 일치도를 비교하였다. SNUH-NSI는 카파 상관계수가 0.498 (P < 0.001), NRS-2002는 카파 상관계수가 0.439 (P < 0.001) 이었다[39]. 또한 브라질의 위암과 대장암 외래환자 137명을 대상으로 한 Vicente 등의 연구에서는 PG-SGA를 기준으로 한 NRI의 민감도와 특이도가 각각 68%, 64%이었다[21].
NRI와 PNI 간에는 영양불량군과 정상군의 두 집단으로 구분하여 계산한 상관관계는 0.68로 다른 영양검색도구들에 비해 높은 상관관계를 나타냈으며, NRI에 대한 PNI의 AUC는 0.86, PNI에 대한 NRI의 AUC는 0.95로 높은 일치도를 나타냈다. 하지만, NRI를 기준으로 산출한 PNI의 민감도는 23.72%로 낮았고, 특이도는 99.85%로 높았다. 두 영양검색도구 간의 일치도 백분율은 77.94%이며, 카파 상관계수가 0.30으로 타당한 수준이었으나, 이는 높은 특이도로 인한 것으로 생각된다. PNI를 기준으로 한 CONUT의 민감도는 90.91%, 특이도는 75.96%로 높았다. PNI와 CONUT의 일치도 백분율은 77%, AUC는 0.91로 높은 일치도를 나타냈다. 중국에서 성인 구강암환자를 대상으로 진단 시점의 BMI, 알부민, NRI, PNI의 예후 가치를 살펴보고자 한 Bao 등의 연구[20]에서 NRI와 PNI의 상관관계는 0.65로 본 연구와 유사한 상관관계를 보였다. 본 연구에서 PG-SGA를 기준으로 하였을 때 NUTRISCORE가 다른 검색도구들에 비해 민감도와 양성예측치가 높았다. 이는 PG-SGA와 NUTRISCORE가 공통으로 섭취량의 최근 변화와 체중감소 상태를 반영한다는 점 때문일 수 있다. 하지만, 특이도가 낮았다. PNI를 기준으로 하였을 때 CONUT은 다른 도구들에 비해 민감도가 높아, 영양불량환자를 식별하는데 높은 일치를 보였다. PNI와 CONUT는 계산 공식에 혈중 알부민과 총 림프구 수 수치가 공통적으로 포함되어, 민감도와 AUC에서 높은 일치도를 보였다. NRI와 PNI는 계산 공식에 혈중 알부민 수치가 공통적으로 포함되며 점수가 낮을수록 영양불량상태가 심화되는 비슷한 점수 체계로 높은 상관관계와 일치도를 보였으나, 낮은 민감도를 보였다.
Pablo 등은 영양검색도구들의 기준과 영양 불량을 정의하는 기준에 따라 영양불량환자의 비율이 다르게 나타날 수 있다고 보았다[40]. 본 연구에서는 PG-SGA에 따른 B와 C에 해당되는 영양불량군이 821명으로 전체의 86.24%이며, NUTRISCORE에 따라 점수가 5점이상인 영양불량군은 817명(85.82%)로 PG-SGA의 영양불량군과 비슷한 분포이고 영양불량군의 비율이 다른 영양검색도구들에 비해 높았다. 수술로 인한 소화기 증상과 급격한 섭취 및 체중 감소가 점수 상승에 크게 영향을 미치므로 그에 따른 영양불량군의 비율이 다른 영양평가지표들에 비해 높게 나타난 것으로 보인다. 이에 비해 객관적 혈액 검사가 반영되는 영양검색도구들인 NRI, PNI, CONUT의 영양불량군은 각각 28.78%, 6.93%, 28.68%였다. 본 연구에서는 기존 문헌에서 제시한 영양상태의 판정 기준을 사용하여 영양상태 정상군과 영양불량군을 구분하였다[29, 30, 31]. 타 연구에서는 NRI 점수의 moderately malnutrition 기준으로 하여 97.5 이상을 정상군, 97.5 미만을 영양불량군으로 정의하기도 하였으며[16], 다른 연구들에서는 해당 연구대상자에 따른 PNI 점수의 중위수[20]나 이환율과 사망률을 반영하는 10번째 백분위수[34]의 cut-off point를 선정하여 반영하기도 하였다. 본 연구에서 타 연구들의 적용 기준인 NRI 97.5점, PNI의 10번째 백분위수 46.6점으로 구분하여 비교해 본 결과, 유사한 일치도를 나타냈다. Kyle 등과 Stratton 등의 연구에서도 동일한 대상자를 검색하더라도 영양검색도구들에 따라 영양불량 분포가 30 ~ 60% 이상까지 다양한 차이를 나타낼 수 있는 것으로 보고되었다[41, 42].
PG-SGA와 NUTRISCORE에서는 수술방법, 위암 병기, 재원 일수, 생화학적 검사 등의 객관적인 요인들에서 정상군과 영양불량군간의 유의적인 차이가 없는 반면, 영양불량군에서 에너지섭취량과 요구량 대비 에너지섭취비율이 정상군에 비해 유의적으로 낮았으며, 수술 후 체중감소도 유의적으로 크게 나타났다. Braga 등이 위 전절제술 환자 23명을 대상으로 6개월간 식사 섭취 및 영양상태에 대해 연구한 바에 의하면 수술 1개월 후 평균 에너지 섭취가 1,458.1 kcal/day였으며[43], Park 등의 연구[44]에서는 수술방법에 상관없이 수술 후 첫 외래 방문 시 에너지 섭취량이 1,388.1 kcal로 1일 에너지 필요량의 73.5% 수준으로 낮았다. 본 연구에서도 전체 평균 에너지가 1,333.4 kcal이며 요구량대비 에너지 섭취 비율이 71.0%로 타 연구들과 큰 차이가 없었다. 다른 타연구들에서는 영양상태에 따른 섭취량을 제시하지 않았으나 본 연구의 PG-SGA와 NUTRISCORE에 따른 영양불량군은 1,300 kcal보다 적게 섭취하고 정상군은 1,600 kcal이상 섭취하여 영양상태에 따라 섭취량의 차이가 크다는 것을 알 수 있었다. NRI에 따른 영양불량군에서도 에너지섭취량과 요구량 대비 에너지섭취비율이 정상군에 비해 유의적으로 낮았으며, 수술 후 체중감소도 유의적으로 크게 나타났다. 이는 PG-SGA, NUTRISCORE, NRI 공통적으로 영양상태를 평가하는데 체중 변화가 반영되므로 섭취량과 체중 감소가 유의적인 연관성이 있다는 것을 확인할 수 있었다.
단백질 섭취량은 영양불량군이 정상군에 비해 낮게 나타나는데, 이는 단백질 섭취량이 PG-SGA, NUTRISCORE, NRI에서의 에너지 섭취 및 체중 감소와 연관성이 있으며, NRI, PNI, CONUT의 점수 산출에 반영되는 알부민 수치와의 연관성에도 기인한 결과로 보인다. 단백질 섭취가 적으면 알부민의 합성과 이화 속도가 낮아지게 되고 단백질 섭취를 증가시키면 정상으로 빠르게 복귀되며[45], 단백질의 섭취량과 소화가 성인과 노인 모두 알부민의 합성 속도에 영향을 미친다고 제시되고 있다[46]. Kim 등의 연구[47]에서 항암치료 시작 시 위암 환자의 단백질 섭취량은 45.7 g/day로, 본 연구에서 영양불량군의 섭취량보다 낮은 수준이었다. Yu 등의 연구[48]에서는 수술 후 퇴원 1개월 시점의 에너지 섭취량이 평균 1,296.1 kcal/day 였으며 체중은 6.5 kg 감소하였고 퇴원 3개월 후에는 6.9 kg까지 지속 감소되는 양상을 보였는데, 이는 퇴원 후 지속되는 저조한 식사 섭취에 따른 영양소 공급 부족과 연관되는 것으로 제시하였다. 본 연구 결과에서도 영양상태가 불량 할수록 식사 횟수가 적고 그에 따라 섭취량이 줄면서 에너지와 단백질 섭취가 부족한 것으로 나타났으며, 이 시기에 적절한 영양 중재가 이루어지지 않을 경우 지속적인 섭취 부족과 체중 감소가 초래될 수 있다. Lee 등의 연구[6]에서는 퇴원 3주 후 평균 에너지 섭취가 영양중재군에서 1,390.5 kcal/day이고 대조군에서 1,227.4 kcal/day였으며, 단백질의 평균 섭취량은 영양중재군에서 60.4 g/day이고 대조군에서 50.5 g/day였다. 3개월 후의 에너지와 단백질 섭취는 영양중재군에서 1,725.6 kcal/day, 73.1 g/day인 반면 대조군에서는 1,539.5 kcal/day, 63.8 g/day로 차이가 유지됨을 보여 주었으며, QOL 결과에서도 영양중재군에서 자기효능감과 식사에 대한 만족감이 유의적으로 높게 나타났다. 이러한 결과는 수술 후 지속적인 영양 평가와 그에 따른 영양 중재 시행이 필요함을 확실히 보여주고 있다.
NRI, PNI, CONUT에 따른 영양불량군의 혈청 알부민, 헤모글로빈, 총 림프구 수, 콜레스테롤의 평균 수치들이 정상군에 비해 유의적으로 낮게 나타났으며, 재원 일수는 유의적으로 높게 나타났다. Lee 등의 연구[34]와 Kanda 등의 연구[49]에서도 수술 전 점수가 낮은 PNI군에서 높은 군에 비해 재원 일수가 유의적으로 많게 나타났다. Ryu 등의 연구[50]에서 수술 전 NRI에 따른 영양불량군에서 알부민, 콜레스테롤 수치가 유의적으로 낮았다. 본 연구에서 NRI, PNI, CONUT에 따른 영양불량군의 특성이 타 연구들의 결과와 유사함을 알 수 있었다. 본 연구에서 NRI, PNI, CONUT에 따른 영양불량군의 평균 알부민 수치가 정상군보다 유의적으로 낮았으나 정상 범위에 해당되었고 타 연구에서도 위절제술 후에 단백질의 부족이 발견되지는 않았음을 제시하고 있다[38]. 이는 체내 항상성 유지 기전에 의해 알부민은 우선적으로 보전되므로 아주 심각한 소모성 증상이 없는 이상 정상으로 유지되며, 반감기가 길고, 수분 상태나 질환 상태 등 영양상태 이외의 변화에 영향을 많이 받을 수 있으므로 혈청 알부민보다는 체중 변화가 더욱 민감한 지표로 판단되기도 한다[39, 44].
수술 후 항암치료를 시행하는 위암 환자는 영양 불량을 심화시킬 수 있는 경구 섭취 와 체중감소상태를 파악하여 개선시키는 것이 중요하므로 PG-SGA나 NUTRISCORE를 활용하여 영양상태를 선별한다면 그 문제점에 따른 영양 중재를 시행할 수 있으므로 섭취 및 체중의 빠른 회복에 효과적일 수 있겠다. PG-SGA는 섭취와 체중감소상태뿐 아니라 소화기 증상, 신체활동, 질병 및 신체검사 등 다양한 항목들이 포함되므로 평가자의 숙련도에 따라 그 신뢰도에 차이가 날 수 있으며 시간이 많이 소요된다. 이에 비해 NUTRISCORE는 섭취와 체중감소상태 외에 종양 위치와 항암 치료에 대한 영양 위험을 반영하며 비교적 간단하고 빠르게 수행할 수 있으므로 이러한 장단점을 이해하고 현장 상황에 맞추어 적절히 선택하여 사용할 수 있겠다. 생화학적 검사 등 객관적인 지표들로 산출되는 NRI와 PNI, CONUT은 수술방법, 병기 등의 객관적 임상 인자 및 재원 일수와 관련성이 있으나, 환자의 최근 식습관 변화에 따라 발생하는 영양 위험을 민감하게 반영할 수 없는 단점이 있다. 따라서 환자의 섭취와 체중감소가 잘 반영되는 PG-SGA나 NUTRISCORE를 활용하여 영양상태를 평가하면서 객관적인 생화학적 지표들로 평가한 NRI, PNI, CONUT을 함께 사용한다면 영양 중재에 좋은 성과뿐 아니라 객관적 임상지표들에 따른 영향을 파악하고 예측하는데 더 효과적일 것이다.
본 연구의 한계점은 첫째, 후향적 단일 센터 연구로 국내 위암 환자 전체를 대표한다고는 할 수 없다. 둘째, 영양상담 시 영양 평가 도구에서의 주관적 문항과 식이 평가 및 분석에서 의도치 않은 오분류가 생겼을 수 있다. 위 절제술 후 1개월 경과 시점의 단면 연구이므로 수술 전 자료에 대한 분석이 없으며, 동일 대상자가 경험하는 영양 상태나 섭취량의 변화 등에 대해 제시하지 않았다. 따라서 위절제 환자의 영양 평가에 대한 영양적 문제 개선 및 생존율과의 관련성을 포괄적으로 규명하기 위해서는 장기간의 추적관찰이 요망된다. 그러나 이러한 한계점에도 불구하고 본 연구는 위 절제술 후 1개월 경과시점에 위암 환자들을 대상으로 5가지 영양검색도구들로 선별된 영양상태의 특성을 비교 분석하고 영양검색도구들 간의 상관관계와 영양불량 선별력의 차이를 알아봄으로써 영양불량 진단 도구 사용에 대한 기초자료를 제공한다는 점에 의의가 있다고 볼 수 있다.
영양 평가는 질병 예후나 생존율 등의 임상 결과와의 연관성에 대한 추가적인 연구가 이루어져야 할 것으로 사료된다. 특히 위암 환자의 치료과정에서 영양 평가와 영양 중재의 개입이 삶의 질과 생존율을 높이는데 효과적임을 확인할 수 있는 연구가 필요하다.
요약 및 결론
본 연구는 수술 후 1개월 경과 시점에 항암치료를 받는 위암 환자 952명을 대상으로 5가지 영양검색도구들을 활용하여 영양상태를 정상군과 영양불량군으로 구분하고 그에 따른 특성을 비교 분석하고자 하였으며, 영양검색도구들 간의 상관관계와 영양불량 선별력 차이를 파악하고자 후향적으로 실시되었다.
5가지 영양검색도구들 중 PG-SGA와 NUTRISCORE에 따라 구분한 영양불량군 비율은 86.24%, 85.82%로 비슷하며 PG-SGA와 NUTRISCORE 간에는 양의 상관관계(r = 0.34)가 있었고, 일치도 백분율은 84.66%, 카파 상관계수는 0.36, AUC는 0.78로 타당한 수준이었다. PG-SGA를 기준으로 한 NUTRISCORE의 민감도와 특이도는 90.86%, 45.80%로 민감도는 높았고, 특이도는 낮았다. NRI와 PNI는 일치도 백분율은 77.94%이며 0.68의 중등도 상관관계, 카파 상관계수가 0.30, AUC가 0.95로 유사성을 보였다. 하지만, NRI 기준과 비교한 PNI의 민감도는 낮은 반면, PNI 기준과 비교한 CONUT의 민감도는 높았다. 또한 PNI와 CONUT의 일치도는 77%, 카파 상관계수는 0.27, AUC는 0.91로 유사성을 보였다. 결과적으로 PG-SGA와 NUTRISCORE 간에, 그리고 PNI와 CONUT 간에 영양불량을 선별하는 높은 민감도를 보였다.
PG-SGA와 NUTRISCORE에서는 수술방법, 위암 병기, 재원 일수, 생화학적 검사 등의 객관적인 요인들에서 정상군과 영양불량군간의 유의적인 차이가 없는 반면, 영양불량군에서 에너지섭취량과 요구량 대비 에너지섭취비율이 정상군에 비해 유의적으로 낮았으며, 수술 후 체중감소도 유의적으로 크게 나타났다. NRI에 따른 영양불량군에서도 에너지섭취량과 요구량 대비 에너지섭취비율이 정상군에 비해 유의적으로 낮았으며, 수술 후 체중감소도 유의적으로 크게 나타났다. 단백질 섭취량은 4개의 영양검색도구들에서 영양불량군이 정상군에 비해 유의적으로 낮게 나타났다. NRI에 따른 영양불량군에서는 정상군에 비해 위 전절제술의 비율이 유의적으로 높게 나타났다. 또한 NRI, PNI, CONUT에 따른 영양불량군의 혈청 알부민, 헤모글로빈, 총 림프구 수, 콜레스테롤의 평균 수치들이 정상군에 비해 유의적으로 낮게 나타났으며, 재원 일수는 유의적으로 높게 나타났다.
따라서 수술 후 항암치료를 받는 위암 환자에게 수술로 인한 섭취 및 체중감소가 반영되는 PG-SGA나 NUTRISCORE를 활용하여 영양불량 상태를 판정하고 영양 중재를 시행할 수 있겠다. NRI, PNI, CONUT을 함께 사용한다면 객관적 임상지표들에 따른 영향을 파악하고 예측하는데 더 효과적일 것이다. 본 연구는 위 수술 후 1개월 경과 시점에 위암 환자의 영양상태를 평가하는 5가지 영양검색도구들을 비교 분석한 기초적인 자료로 활용될 수 있으나, 향후 지속 관찰을 통해 임상 결과의 향상 및 생존율 예측에 대한 연구가 필요할 것으로 사료된다.
Retracted in: 대한지역사회영양학회지 26(6): 508, 2021
Conflict of Interest:There are no financial or other issues that might lead to conflict of interest.
Acknowledgments
The authors are grateful to the staffs of the Samsung Medical Center who generously cooperated this study.
감사의 글
저자들은 본 연구에 아낌없이 협조해주신 삼성서울병원 직원들에게 감사드립니다.
References
-
International Agency for Research on Cancer. Incidence, mortality and prevalence by cancer site [Internet]. Globocan; 2020 [cited 2022 Jun 02].Available from: https://gco.iarc.fr/today/data/factsheets/populations/900-
world- fact- sheets.pdf.
-
-
International Agency for Research on Cancer. Cancer incidence and mortality statistics worldwide and by region [Internet]. Globocan; 2020 [cited 2022 Jun 02].
-
-
National Cancer Information Center. Incidence status by cancer type for Korea in 2019 [Internet]. National Cancer Information Center Korea; 2022 [cited 2022 Jun 02].Avalable from: https://cancer.go.kr/lay1/S1T639C641/contents.do.
-
-
National Cancer Information Center. Mortality by major cancer type for Korea in 2020 [Internet]. National Cancer Information Center Korea; 2022 [cited 2022 Jun 02].Avalable from: https://cancer.go.kr/lay1/S1T645C646/contents.do.
-
-
Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol 2017;39(7):1010428317714626
-
-
Ryo S, Kanda M, Ito S, Mochizuki Y, Teramoto H, Ishigure K, et al. The controlling nutritional status score serves as a predictor of short- and long-term outcomes for patients with stage 2 or 3 gastric cancer: Analysis of a multi-institutional data set. Ann Surg Oncol 2019;26(2):456–464.
-
-
Vicente M, Barão K, Silva TD, Forones NM. What are the most effective methods for assessment of nutritional status in outpatients with gastric and colorectal cancer? Nutr Hosp 2013;28(3):585–591.
-
-
Amin MB, Edge S, Greene F, Byrd DR, Brookland RK, Washington MK, et al. In: AJCC Cancer Staging Manual. 8th ed. New York (NY): 2016.
-
-
Zini G. Abnormalities in leukocyte morphology and number. In: Porwit A, McCullough J, Erber W, editors. Blood and bone marrow pathology. 2nd ed. Philadelphia: Churchill Livingstone; 2011. pp. 247-261.
-
-
WHO/IASO/IOTF. The Asia-Pacific perspective: redefining obesity and its treatment. Sydney: 0-9577082-1-1Health Communications Australia, Melbourne; 2000. pp. 15-21.
-
-
Elliot L, Molseed L, McCallum PD. In: The clinical guide to oncology nutrition. Chicago: American Dietetic Association; 2006. pp. 54-71.
-
-
Ottery FD. Definition of standardized nutritional assessment and interventional pathways in oncology. Nutrition 1996;12(1):S15–S19.
-
-
Buzby GP, Knox LS, Crosby LO, Eisenberg JM, Haakenson CM, McNeal GE, et al. Study protocol: A randomized clinical trial of total parenteral nutrition in malnourished surgical patients. Am J Clin Nutr 1988;47(2):366–381.
-
-
de Ulíbarri JI, González-Madroño A, de Villar NG, González P, González B, Mancha A, et al. CONUT: A tool for controlling nutritional status. First validation in a hospital population. Nutr Hosp 2005;20(1):38–45.
-
-
Sanz EA, Siles MG, Fernández LR, Roldán RV, Domínguez AR, Abilés J. Nutritional risk and malnutrition rates at diagnosis of cancer in patients treated in outpatient settings: Early intervention protocol. Nutrition 2019;57:148–153.
-
-
Sanz EA, Abilés J, Siles MG, Ruíz FR, Goitia BT, Domínguez AR. Evaluation of a protocol to detect malnutrition and provide nutritional care for cancer patients undergoing chemotherapy. Sci Rep 2020;10(1):21186
-
-
Kim Y, Kim WG, Lee HJ, Park MS, Lee YH, Kong SH, et al. Comparison of the impact of malnutrition by nutritional assessment and screening tools on operative morbidity after gastric cancer surgery. J Korean Soc Parenter Enter Nutr 2011;4(1):7–15.
-
-
Braga M, Zuliani W, Foppa L, Di Carlo V, Cristallo M. Food intake and nutritional status after total gastrectomy: Results of a nutritional follow-up. Br J Surg 1988;75(5):477–480.
-
-
Park YO, Yoon SY, Kang SS, Han SM, Kang EH. Nutritional status and dietary change after gastrectomy of gastric cancer patients. Korean J Community Nutr 2012;17(1):101–108.
-
-
Kim WG, Park MS, Lee YH, Heo DS. Nutritional risk in oncology outpatients receiving chemotherapy. Korean J Community Nutr 2008;13(4):573–581.
-
-
Yu EJ, Kang JH, Yoon S, Chung HK. Changes in nutritional status according to biochemical assay, body weight, and nutrient intake levels in gastrectomy patients. J Korean Diet Assoc 2012;18(1):16–29.
-

 KSCN
KSCN



 Cite
Cite